آناتومی رحم و بیماریهای آن
به گزارش وبلاگ دوست، رحم یک عضو عضلانی توخالی است که در داخل لگن حقیقی بین مثانه و رکتوم واقع است و از سه لایه مجزا تشکیل شده است: سروز یا پوشش پریتونئال خارجی، میومتر و اندومتر. به علت موقعیت خاص، پاسخ فیزیولوژیک هم به فاکتورهای متعدد از جمله سطوح هورمونی و عفونت ها ممکن است بسیاری ازاختلالات و علائم،چه خوش خیم و چه
آناتومی رحم و بیماریهای آن
نویسندگان:دکترابوطالب صارمی و دکتر یزدی نژاد و همکاران
بیماریهای رحم
Diseases of te uterusرحم یک عضو عضلانی توخالی است که در داخل لگن حقیقی بین مثانه و رکتوم واقع است و از سه لایه مجزا تشکیل شده است: سروز یا پوشش پریتونئال خارجی، میومتر و اندومتر. به دلیل موقعیت خاص، پاسخ فیزیولوژیک هم به فاکتورهای متعدد از جمله سطوح هورمونی و عفونت ها ممکن است بسکمک ازاختلالات و علائم،چه خوش خیم و چه بدخیم در آن ایجاد شود که در این مقاله مورد بحث قرار خواهندگرفت.
آنومالی های رحمی
آنومالی های مادرزادی: اثرات رحمی در معرض قرار گرفتن دی اتیل استیل بسترول
اولین بار در سال 1977 Kaufman و همکاران گزارش کردند که قرارگرفتن جنین در معرض دی اتیل استیل بسترول (DES) در داخل رحم همراه با اختلالات قسمت فوقانی دستگاه تناسلی است. آنها توضیح دادند که این اختلالات قسمت فوقانی دستگاه تناسلی است.آنها توضیح دادند که این اختلالات می توانند به صورتهای مختلف ظاهر شوند: یک رحم T شکل، باندهای فشارنده در داخل حفره رحم، رحم هیپوپلاستیک و با شیوع کمتر نقائص پولیپ مانند در داخل رحم و چسبندگی ها (شکل 1 و 2). در مقاله اصل خود آنها به این نکته اشاره کردند که این نقائص ممکن است اثر منفی برروی بارداری های بعدی داشته باشند. درطی ده سال بعد از آن، Kaufman و سایر محققات اثرات اختلالات فوقانی دستگاه تناسلی را که در هیستروسالپنگوگرافی به اثبات رسیده بود بر روی نتایج بارداری تحت آنالیز قراردادند.یافته های جالب و قابل توجه ای از این مطالعات به دست آمد از جمله اینکه فرکانس ناهنجاری های رحمی با توجه به اینکه موارد گزارش شده از بازنگری پفراینده ها تعیین شده باشند یا به دلیل مراجعه خود بیماران علاقمند آنالیز شده باشند بسیار متغیر است. یافته دیگر این بود که ارتباط روشنی بین تغییرات اپی تلیوم واژن و سرویکس (مثل آدنوز) و اختلالات اثبات شده قسمت فوقانی دستگاه تناسلی دارند بیشتر از آنان که در معرض DES قرار گرفته اند ولی هیستروسالپنگوگرام نرمال دارند در معرض پیامدهای ناگوار بارداری که بیشترین آن زایمان زودرس و بارداری خارج رحمی است قرار دارند.مطالعات حیوانی پیشنهاد نماینده این است که پایه آناتومیک این ناهنجاری ها به دلیل توقف رشد قسمت فوقانی مجاری مولرین و عدم توانایی دیواره های داخلی و خارجی استرومای رحم در جدا شدن از یکدیگر به صورت طبیعی است که هنگامی که جنین حیوان در داخل رحم در معرض DES قرار بگیرد رخ می دهد. هرچند مطالعات متعددی باروری را در زنان قرار گرفته درمعرض DES زیر سوال برده اند، هیچ ارتباط اثبات شده ای بین DES و ناباروری وجود ندارد.هر چند هیچ گونه دلیل روشنی به نفع اینکه نازایی در زنانی که هیستروسالپنگوگرام غیر عادی دارند افزایش می یابد دردست نیست،ولی زیرگروهی از این ناهنجاری ها مثل رحم T شکل وجود دارند که با تنگی های قسمت فوقانی رحم ارتباط داشته و از لحاظ آماری همراهی بیشتری با عدم توانایی بارداری دارند.متاسفانه درمان ناهنجاری های فوقانی دستگاه تناسلی که با پیامدهای ناگوار بارداری همراهند،بسیار محدود است. از آنجا که جهت بهبود بخشیدن به پیامدهای بارداری در این بیماران کارچندانی نمی توان انجام داد،تشخیص ناهنجاری رحمی چه از طریق یافته های هیستروسالپنگوگرام و چه
یافته هایی به نفع تغییرات ساختمانی اپی تلیوم سرویکس یا واژن باید برای پزشک به منزله زنگ خطری جهت افزایش احتمال بارداری خارج از رحم و یا زایمان زودرس تلقی شود. در اوایل حاملگی این بیماران را باید سونوگرافی ترانس واژینال آنالیز کرد که وجود یک ساک بارداری داخل رحمی ثابت شود و سپس با افزایش سن بارداری باید با سونوگرافی و یا معاینات انگشتی سریال سرویکس را از نظر احتمال دیلاتاسیون و افنامان زودرس ارزیابی نمود. اگر چنین تغییراتی به اثبات برسد بیماران باید تحت عملی سرکلاژ گردن رحم قرار گیرند. جالب است بدانیم که ناهنجاری های مادرزادی قسمت فوقانی دستگاه تناسلی که با DES در ارتباطند، برخلاف ناهنجاری های مشابه غیر مرتبط DES، هیچ رابطه ای با افزایش ناهنجاری های دستگاه ادراری که با IVP به اثبات رسیده است ندارند.
شکل 1:رحم Tشکل همراه با انسداد .نیمه تحتانی رحم یک نمای پیازی شکل دارد و کانال سرویکس واجد یک نمای قیفی است.
آنومالی های اکتسابی: سندرم آشرمن
سندرم آشرمن به منزله وجود انسداد در تمام و یا بیشتر قسمتهای حفره اندومتر می باشد که تقریباً همواره نتیجه دیلاتاسیون و کورتاژی است(D&C) که به دلیل خونریزی پس از زایمان (یک یا چند روز پس از زایمان)،D&Cهای متعدد جهت خونریزی های پایدار رحمی انجام می شود و یا D&C به دلیل یک سقط عفونی می باشد. در غیاب بافت کافی آندومتر، به خصوص اگر یک فرایند التهابی هم وجود داشته باشد، بافت باقیمانده رحم با کلاژن جایگزین شده و باعث ایجاد چسبندگی ها و یا باندهایی در داخل آن می شود. هر چند اغلب ، شکایت این بیماران از آمنوره یا هیپومنوره است،سندرم آشرمن ممکن است باعث ایجاد نازایی یا سقط های راجعه خودبخودی با یا بدون آمنوره شود. پس از گرفتن توضیح حال،ارزیابی بیماران شامل انجام یک هیستروسالپنگوگرام است که اغلب عدم وجود حفره رحمی و یا دفرمیتی های شدید را در آن نشان می دهد که منجر به انسداد قسمتهایی از حفره رحم شده است. قبل از انجام این کار، می توان وجود یا غایب یک اندومتر فعال را با یک آزمایش استروژن -پروژسترون تنها عاملی که باعث ایجاد خونریزی رحمی می شود وجود یک اندومتبرطرفال است.به این منظور می توان بیماران را به مدت 21 روز تحت درمان روزانه با استروژن کنژوگه قرار داد و سپس در ده روز آخر این سیکل یک پروژستین را هم به استروژن اضافه نمود. تقریباً 5تا 7 روز پس از قطع درمان هورمونی خونریزی واکنشی رخ خواهد داد. بدیهی است که قبل از تجویز این هورمون ها باید بارداری را در بیماران رد نمود.درمان بهینه جهت سندرم آشرمن شامل از بین بردن چسبندگی های داخل رحم از طریق هیستروسکوپ است. بعد از انجام جراحی، یک وسیله داخل رحمی هم اغلب در داخل حفره رحم قرار داده می شود که داخل حفره باز بماند و دیواره های آن از یکدیگر جدا شوند. پس از آن درمان استروژن و پروژستین دوره ای با دوز بالا به منظور ایجاد پرولیفراسیون اندومتر تجویز می شود.دربیشتربیماران،این درمان کافی است، ولی ندرتاً ممکن است چسبندگی داخل رحم مجدداً تشکیل شود.
بیماریهای خوش خیم رحم
هماتومترا وپیومترا
یک حفره رحمی بزرگ و پراز مایع معمولاً نشان دهنده وجود هماتومترا یا پیومترا است. هردوی این شرایط همراه با تنگی های مادرزادی یا اکتسابی سرویکس بوده و یا با سایرانسدادهای مجرای خروجی مثل پرده بکارت سوراخ نشده یا دیواره عرضی واژن ارتباط دارند، در بیماران جوان، علائم و نشانه های شایع شامل آمنوره اولیه، دیس منوره،اندومتریز و نازایی هستند. ندرتاً اگرمایع داخل رحمی به صورت چرکی باشد (پیومتر)،می تواند به دلیل فشار داخل حفره از طریقلوله های فالوپ وارد حفره پریتوان شده و از این طریق ایجاد پریتونیت و عفونت منتشر خونی نماید.هنگامی که آنومالی های قسمت تحتانی دستگاه تناسلی رد شدند باید احتمال وجود یک تنگی اکتسابی سرویکس را که بیشتراً ازنوع ایاتروژنیک است در نظر داشت.علل شایع تنگی های آیاتروژنیک سرویکس شامل مخروط برداری،کرایو، کوتر و کوترهای حرارتی سرویکس جهت درمان ضایعات پیش بدخیم سرویکس است. بیمارانی که در معرض بیشترین خطر تنگی های سرویکس در پی درمان بیماریهای سرویکس هستند کسانی می باشند که در داخل رحم در معرض DES قرار گرفته اند که احتمالاً به دلیل وجود نقص در استرومای سرویکس آنان است.دیگرعلل تنگی سرویکس شامل بدخیمی هایی که اگزویااندوسرویکس را درگیرمی نمایند ویا در قسمت تحتانی رحم واقع شده اند، سرویسیت ها، آتروفی به دلیل افزایش سن یا ترومای ناشی از زایمان هستند. درمان تنگی های اکتسابی سرویکس به وضوح بستگی به علائم بیماران و تمایل آنها به حفظ باروری دارد. اغلب تلاش ها به منظور باز کردن سرویکس همراه با عود تنگی آن است.درحال حاضر، به نظر می رسد موثرترین درمان برداشتن بافت فیبروتیک سرویکس که اطراف کانال اندوسرویکس را احاطه نموده از طریق لیزر باشد.
تشخیص هماتومترا یا پیومترا زمانی مطرح می شود که بیمار از آمنوره یا کرامپ های قسمت تحتانی شکم شکایت داشته و در معاینه لگنی یک رحم بزرگ و کروی به دست می خورد تشخیص از طریق سونوگرافی اثبات شده و درمان شامل D&C و در صورت امکان، برطرف نمودن انسداد است. وقتی تشخیص پیومترا داده شد، علاوه بر درناژ تجمع مایع،بیمار باید تحت درمان آنتی بیوتیکی که ارگانیسم های شایع مانند باکتروئیدها،بیهوازی ها،استافیلوکوک ها،استرپتوکوک ها و کلی فرمهای بی هوازی را می پوشانند قرار گیرد.قراردادن یک کاتتر قارچی شکل بزرگ در داخل رحم با پیروزیت متغیر امتحان شده است ولی باز کردن سرویکس هر چند روز یک بار در خالی کردن پتومترا تاثیر بیشتری دارد. شکل 2:رحم کوچکTشکل،با رسوخ ماده رنگی از کاویته ی رحم به داخل اندومتر.
آندومتریت
اندومتریت یک واکنش التهابی اندومتراست و به اشکال حاد و مزمن اتفاق می افتد که بستگی به نوع عامل التهاب زا دارد. آندومتریت مزمن اغلب بر اساس عوامل اتیولوژیک مختلف طبقه بندی می شود. اندومتریت حاد براساس یافتن تجمع لکوسیت های پلی مورفونوکلئر (PML) به صورت موضعی که تشکیل میکروآبسه داده اند ویا مجرای غدد را پرنموده اند تشخیص داده می شود.این یافته،با انفیلتراسیون PML ها در استروما همراه با نکروز و خونریزی که در طی فاز نرمال سیکل های قاعدگی اتفاق می افتد فرق دارد.به نظر می رسد بیشتر اپیزودهای اندومتریت حاد،در پی عفونت هایی رخ می دهند که از طریق سد دفاعی تخریب شده سرویکس به طرف بالا صعود نموده اند. سد دفاعی طبیعی سرویکس در طی قاعدگی،هرگونه دستکاری داخل سرویکس، سقط و زایمان ضعیف می شود.با تخریب این سد دفاعی،ارگانیسم های مختلف می توانند به حفره
اندومترداخل شوند ولی معمولاً ایجاد عفونت نمی نمایند.شایعترین موارد مهم کلینیکی اندومتریت حاد همراه با بارداری یا سقط اتفاق می افتاده و اغلب از طریق استرپتوکوک ها،استافیلوکوک ها، نیسریا یا کلستریدیوم ها ایجاد می شوند. کشت بافت اندومتر چه از طریق سواب به دست آمده باشد و یا در زمان کورتاژ خارج شده،جهت تشخیص عامل بیماریزا و انتخاب آنتی بیوتیک مناسب لازم است.
آندومتریت مزمن بواسطه یافتن پلناماسل ها به نام بخشی از فرایند التهابی، همراه با وجود لنفوسیت ها و ماکروفاژها تشخیص داده می شود.اغلب،اندومتریت فاقد فرم های تیپیکی است که تاریخ بندی دقیق آن را براساس روزهای سیکل قاعدگی تعیین کند.یافته های شایع دیگر که در تشخیص هیستولوژیک مطرح می شود شامل تغییر شکل دوکی سلول های استروماست. همچنین ممکن است در موارد اندومتریت مزمن،متاپلازی اسکواموس همدیده شود. علائم کلینیکی اندومتریت مزمن بسیار متغیر است و از موارد بدون علامت تا خونریزی قاعدگی نامنظم و سالپنژیت را شامل می شود.ممکن است بیمار با شکایت منومتروراژی،حساسیت رحمی و یک ترشح موکوسی چرکی از واژن مراجعه کند. تشخیص بافت شناسی اندومتریت مزمن در 41% موارد به همراه سقط، 25% به همراه سالپنژیت و 14درصد به همراه IUD و 0/012 همراه با حاملگی اخیر دیده می شود.اندومتریت مزمن همچنین در حضور بافت نکروتیک اندومتر مثل یک پولیپ یا کارسینوم عفونی یا در پی تنگی های سرویکس در ارتباط با رادیاسیون قبلی یا بدخیمی های سرویکس در ارتباط با رادیاسیون قبل یا بدخیمی های سرویکس رخ می دهد.دربیمارانی که اندومتریت مزمن بدون اتیولوژی تعیین رخ می دهد، باید کشت اندوسرویکس برای نیسریا و کلامیدیا انجام شود.چون اغلب کشت های سرویکس برای یکی از این ارگانیسم ها مثبت است حتی اگر کشت اندومتر منفی باشد.
اندومتریت مزمن همچنین ممکن است همراه با ارگانیسم های خاصی همانند میکوپلناما،مایکوباکتریوم توبرکلوزیس، قارچها،ویروس ها وانگل ها رخ دهد. به نظر می رسد در عفونت های توبرکلوزی، درگیری اندومتر به دلیل انتشار ارگانیسم از لوله های فالوپ در پی بخش ارگانیسم چه از راه خونی و چه لنفاتیک از یک کانون اولیه در ریه ها یا دستگاه گوارش است. سل دستگاه تناسلی در 3 تا 8 درصد از زنان مبتلا به بیماریهای ریه رخ داده و اغلب یک یافته اتفاقی در زمان لاپاراتومی به دلیل بیماری التهابی لگن یا نازایی است. باید به منظور یافتن ارگانیسم مسئول آن از هیچ تلاشی فروگذار نکرد چراکه در انتخاب درمان مناسب موثراست.
آدنومیوز
آدنومیوز یک بیماری خوش خیم رحم است که از طریق فضاهایی از غدد و استرومای اندومتر که در داخل بافت میومتر جایگزین شده اند تعیین می شوند (شکل3). آدنومیوز به طور خودبخود از غدد لایه بازال اندومتر سرچشمه می گیرد و نتیجتاً این غدد تحت تغییرات ترشحی و پرولیفراسیون دوره ای که در لایه های سطحی تر آندومتر به چشم می خورد قرار نمی گیرند.معمولاً پیوستگی میان لایه بازال اندومتر و نواحی آدنومیوز داخل آن وجود ندارد و اغلب موارد حداقل 2/5 میلی متر (با بزرگنمایی ضعیف) از میومتر نرمال بین دو ناحیه آدنومیوز دیده می شود.میزان بروز گزارش شده آدنومیوز بسیار متغیر است که بستگی به کفایت آنالیز بافتی دارد. با بدست آوردن مقاطع سریال بافتی از دیواره رحم،ممکن است میزان بروز، بالغ بر 60% در زنان هیسترکتومی شده بین 40 تا 50 سال باشد. در آنالیزهای معمول بافتی،آدنومیوز در 5 تا 10 درصد زنان یائسه و 15درصد زنان زیر چهل سال گزارش شده است. آدنومیوز در 50% از موارد در همراهی با لیومیوم های رحم دیده می شودو در کمتر از بیست درصد موارد با آندومتریوز گزارش شده است.پاتولوژی و هیستوژنز
تئوری های متعددی در موارد هیستوژنز آدنومیوز مطرح شده که بیشتراً به اثبات نرسیده اند و پذیرفته شده ترین آنان بر اساس مورد تهاجم قرار گرفتن میومتر از طریق اندومتر بازال است.ازجایی که آدنومیوز اغلب در زنانی که زایمان انجام داده اند دیده می شود،یک هیپوتز این است که اندومتریت مزمن پس از زایمان ممکن است منجر به تخریب سد دفاعی بین اندومتر و میومترشده و ابتدا استروما وسپس غدد آغاز به تهاجم به داخل میومتر از طریق کانال های لنفاوی و خونی نمایند.ازلحاظ ماکروسکوپی،ادنومیوز در 2 نمای مختلف تظاهر می یابد: درگیری منتشر و موضعی میومتر.اغلب،رحم به طور گلوبال بزرگ شده و درگیری منتشر در هر 2 دیواره قدامی و خلفی آن وجود دارد ولی اغلب درگیری در دیواره خلفی بیشتراست. در سطح برش یافته،میومتر ضخیم شده و نمای نامنظم دارد. ممکن است نواحی نازکی از بافت شفاف که از سطح برش داده شده به خارج برجسته شده است دیده شود که درامتحان میکروسکوپیک حاوی غدد و استرومای اندومتر است که در تمام میومتر پراکنده شده اند. نوع دوم بیماری، به صورت نواحی کانونی است که به نام آدنومیوم شناخته شده و می تواند ایجاد یک رحم نامتقارن نماید. ممکن است در نمای ظاهری تشخیص این نواحی کانونی از میوم سخت باشد. تشخیص افتراقی در سطح برش داده شده از طریق ندول هایی که به سختی از میومتر اطراف خود قابل تشخیص می باشند داده می شود که برخلاف میوم اغلب از قسمت فوقانی میومتر برجسته نشده اند.
ظاهرات بالینی
اغلب زنان مبتلا به آدنومیوز، بدون علامت بوده و یا تنها علائم مختصری مثل منوراژی خفیف یا دیس منوره دارند.اغلب موارد علامت دار در زنان 35 سال 50 سال گزارش شده است.علائم کلاسیک آدنومیوز شامل دیست منوره ثانویه (15 تا 30 درصد) ومنوراژی (40 تا 50درصد) همراه با دیس منوره ای است که به تدریج افزایش شدت بیماری شدت می یابد. در موارد پیشرفته ممکن است دیس پارونی عمیق و درخط وسط شکایت غالب باشد. در معاینه لگن،اغلب رحم به طور منتشر بزرگ بوده و معمولاً در لمس،به خصوص در فاز قبل از سیکل قاعدگی حساس است. به دلیل تظاهرات متغیر این عارضه، آدنومیوز درحال حاضر تنها در 0/025از موارد،قبل از عمل جراحی تشخیص داده می شود.هم سونوگرافی واژینال و هم MRI ممکن است در افتراق آدنومیوز از میوم کمک نماینده باشند که این افتراق به خصوص در زمانی که یک روش جراحی محافظه کارانه مثل میومکتومی جهتبیمار درنظر گرفته می شود مهم است.
درمان آدنومیوز
هیچ درمان طبی که درطولانی مدت جهت آدنومیوز موثرباشد شناخته نشده است.در بیماران انتخابی می توان از قرص های جلوگیری از بارداری به صورت دوره ای استفاده نمود ولی میزان پیروزیت متغیراست و گزارشات پراکنده ای دال بر بدتر شدن علائم بیماری با قطع قرص ها وجود دارد. مهارنماینده های سنتتاز پروستاگلاندینی هم ممکن است باعث برطرف نمودن درد و کاهش خونریزی بیمار شوند ولی باز هم پیروزیت متغیر بوده و اغلب کوتاه مدت است.هرچند اگونیستهای GnRH ممکن است درسرکوب آدنومیوز موثر باشند ولی این تاثیرتنها تا زمانی که این داروها تجویز می شوند ادامه دارد و بلافاصله بعد از قطع درمان علائم و نشانه های بیماری بازگشت خواهد کرد.ازآنجا که هیچ جراحی محافظه کارانه ای جهت آدنومیوز وجود ندارد، درمان با آگونیست های GnRH قبل ازعمل ضروری نیست.دربیماران علامتدار که خواهان حفظ باروری خود نیستند درمان انتخابی هیسترکتومی است که بسته به مجموع شرایط طبی و بالینی بیمار می تواند از راه شکم یا واژن انجام شود.بیماریهای اندومتر
اختلالات عملکردی
تعیینه ریزش نامنظم اندومتر،خونریزی های سنگین و طولانی در زمان قاعدگی است که اغلب این خونریزی ها بیشتر از 2 هفته ادامه دارد. تشخیص از طریق کورتاژ رحم بعد از روز پنجم یاششم خونریزی قطعی می شود. امتحان میکروسکوپی نمونه های کورتاژ اندومتر قاعدگی تیپیک پس از تخمک گذاری را نشان می دهد و همچنین ممکن است حاوی نواحی از اندومتر در مراحل اولیه پرولیفراتیو باشد.به نظر می رسد که این یافته غیرعادی به دلیل عملکرد پا برجای کورپوس لوتئوم و تولید مقادیر زیاد پروژسترون باشد و اغلب همراه با یک کیست کورپوس لوتئوم دیده می شود.هم علائم کلینیکی و هم پاتولوژی اندومتر می تواند با تجویز پروژسترون در طی فاز قبل از سیکل قاعدگی بهبود یابد.این شرایط اغلب در زنان بین 24 تا 50 سال دیده می شود و ممکن است به صورت مکرر وجود داشته باشد و یا تنها در سکیل دیده شود. گذشت زمان و کورتاژ رحمی که به منظور تشخیص انجام می شود اغلب دربهبود بیماری موثرند.پولیپ ها
پولیپ های اندومتر نواحی پایه داری هستند که به دلیل رشد بیش از حد غدد و استرومای اندومتر که در بالای سطح اندومتر برجسته شده و ندرتاً از کانال اندوسرویکس بیرون میزنند تعیین می شوند. آنها به صورت پولیپ های منفرد یا متعدد رشد می نمایند و اغلب از اندومترهیپرپلاستیک تشکیل شده اند. میزان پولیپ های اندومتر از چند میلی متر تا چند سانتی متر متغیر است و ممکن است به صورت پهن و یا پایه دار باشند. بیشتر پولیپ ها بدون علامتند و آنها که علامتدارند با الگوهای متغیرخونریزی تظاهرمی یابند.ازآنجا که پولیپ های اندومتر اغلب در همراهی با میوم های رحم و هیپرپلازی اندومتر دیده می شود،تعیین دقیق اینکه کدام یک از علائم حقیقتاً از طریق پولیپ ایجاد شده اند مشکل است.پولیپ های اندومتر اغلب یک یافته اتفاقی در زمان D&C یا هیسترکتومی هستند.در صورت علامتدار بودن، نمای بالینی به صورت یکی از انواع خونریزی های غیر عادی رحمی است که شامل خونریزی بعد از یائسگی هم می شود.هرچند اوج شیوع نسبی آن بین 40 تا 50 سال است در بیماران دوازده ساله تا بیش از هشتاد سال هم گزارش شده است.در ظاهر پولیپ های اندومتر طلایی یا قرمز- قهوه ای هستند ویک پایه عروقی دارند .از لحاظ بافت شناسی ،یک پولیپ از غدد ،استروما و عروق تشکیل شده که تقریبا2/3 آنها حاوی یک اندومتر نابالغ هستند که یک نمای هیپرپلاسیتک کیستیک بسته به فازسیکل قاعدگی دارد (شکل4). 1/3 دیگر پولیپ از اندومترعملکردی تشکیل شده که تحت تغییرات دوره ای بافتی قرارمی گیرد.ترانسفورماسیون بدخیم با درجه پایش در 0/5% از پولیپ ها دیده میشودو کانسر همزمان اندومتر هم در تقریباً 10% خانمهای منوپاز مبتلا به پولیپ وجود دارد.
تشخیص پولیپ اندومتر اغلب در زمان کورتاژ یا هیسترکتومی داده می شود،هر چند با افزایش استفاده از سونوگرافی واژینال و سونوهیستروسکوپی این پولیپ ها با شیوع بالایی قبل از عمل تعیین می شوند. ندرتاً ممکن است یک پولیپ اندومتر از سوراخ سرویکس خارج شده و با یک پولیپ سرویکس اشتباه شود (شکل5).
پولیپ ها اغلب در زمان کورتاژ یافت نمی شوند.مگر
اینکه یک وسیله گیره ای که بتواند حفره اندومتر را به دقت آنالیز کند استفاده شود.بنابراین توصیه می شود یک فورسپس خصوص پولیپ به طور روتین در زمان D&C مورد استفاده قرار گیرد. هیستروسکوپی می تواند راهنمای مستقیم چمشی جهت تشخیص و برداشتن تمام پولیپ های ایجاد و بدون استفاده از این تکنیک تا 25 درصد از پولیپ ها ممکن است تشخیص داده نشوند.
سایرتومورهای خوش خیم رحم
سایر تومورهای خوش خیم رحم شامل آدنومیوم ها، تراتوم و لنفانژیوم و همچنین وجود بافت های هتروژن (بافت هایی که به اندومتر تعلق ندارند) می باشد. بیشتر این تومورها بسیار نادر بوده و موارد محدودی از آنها گزارش شده و هیچ سندرم کلینیکی خاصی همراه با آنان دیده نمی شود. آنها اغلب به صورت یک یافته اتفاقی در زمان هیسترکتومی کشف می شوند و اگر قبل از عمل دیده شوند با لیومیوم اشتباه می شوند.آدنوم های پولیپوئید آتیپیک از لحاظ ظاهری شبیه به پولیپ های آندومتر بوده و اغلب از سگمان تحتانی رحم منشا می گیرند. آنها به طور تیپیک در زنان واقع در دوره تولید مثل و نزدیک به منوپاز دیده شده و اغلب همراه با خونریزی های نامنظم رحم می باشند. به طور میکروسکوپی، ضایعات از غدد هیپرپلاستیک با اشکال نامنظم تشکیل شده که در داخل عضلات صاف واقع شده اند و در یک نمونه کورتاژ ممکن است تشخیص آنها از هایپرپلازی اندومتر،آدنوکارسینوم مهاجم و تومورهای مختلط مولرین سختباشد. علی رغم آتیپی سیتولوژیک این ضایعه، سیر کلینیکی آن خوش خیم است و یک کورتاژساده در زنانی که خواهان حفظ باروری خود هستند، ممکن است درمان نماینده باشد.
تراتوم رحم یک ضایعه بسیار نادر است که در مطالعه میکروسکوپی شباهت به تراتوم تخمدان دارد. به طور تیپیک،این نئوپلنام از طریق اپی تلیوم اسکواموس مفروش شده و حاوی اپی تلیوم تنفسی، بافت چربی و غدد سباسه می باشد.
لنفانژیوم ها اغلب ندول های کوچک و حلقوی هستند که از یک شبکه کانال لنفاوی در یک زمینه بافت همبند فیبروز تشکیل شده اند.
همانژیوپری سیتوم یک تومور نادر است که از مویرگهای غیر نئوپلاستیک تشکیل شده که از طریق شبکه ای از پری سیت های نئوپلاستیک احاطه شده اند .این تومور معمولاً به طور تصادفی یافت شده و گاهاً با آدنومیوزاستروما اشتباه می شود.
لیپوم یک نوع بافت چربی تکامل یافته است که حفره حفره بوده و زرد رنگ و کپسول دار است.اغلب می توان لیپوم را از میوم به واسطه دژنرسانس چربی و بافت های باقیمانده عضلات صاف در میوم تشخیص داد.
سیست یا رشد آدنوماتوز کوچک در دیواره جانبی رحم نادراست. فرض براین است که این ضایعات از بقایای مجرای مزونفریک یا لوله ها سرچشمه می گیرند. در موارد بسیار نادر، این ضایعات ممکن است به صورت نئوپلنام های بدخیم در آیند. وجود بافت هتروژن در داخل رحم مانند استخوان، غضروف، عضله صاف و بافت گلیال گزار ششده است. اگر این بافت ها بدخیم باشند، نمایانگر وجود یک تومور بدخیم مختلط مولرین هستند. یک توضیح احتمالی برای یافتن بافت جنینی پس از سقط و دستکاری داخل رحم در آنجا جایگزین شده است.
هیپرپلازی اندومتر که نمایانگر رشد بیش از حد غدد و استرومای اندومتر است. معمولاً در یک زمینه اندومتر پرولیفراتیو در پاسخ به تحریک طولانی مدت استروژن بلامنازع ایجاد می شود. سالها تصور می شد بافت طبیعی پرولیفراتیواندومتر به سمت یک کارسینوم درجا (in situ) است. این تئوری براساس یافته ها و مطالعات آینده نگری بود که در آغاز از طریق Gusberg و Kaplan در سال 1963 ارائه شد در آن مطالعه، محققان گزارش کردند که 20% از بیمارانی که تحت هیسترکتومی قرار گرفتند یک آدنوکارسینوم همزمان داشتند و کانسراندومتر در حدو 12% از بقیه بیماران با یک پیگیری حدود 5/3سال بوجود آمد. آنها خاطر نشان کردند که خطر ایجاد کانسر در زنان مبتلا به هایپرپلازی اندومتر به نحو قابل ملاحظه ای بالاتر بود و میزان میانه ریسک آن در عرض 10 سال تقریباً 30% بود.
در عرض سالیان اخیر، سیستم های طبقه بندی مختلفی ارائه شده است که در نتیجه آن اختلاف نظر هم، چه در زمینه معیارهای تشخیصی و چه در مورد پیش آگهی زیرگروههای مختلف هایپرپلازی اندومتربوجود آمده است.اخیراً جامعه بین المللی پاتولوژیست های زنان، یک سیستم طبقه بندی ارائه نموده که هم معیارهای آناتومیک (درجه تراکم و تنوع غدد) وهم معیارهای سیتولوژیک، به خصوص آتیپی سلولی را در آن مورد استفاده قرار دادند. هایپرپلازی ساده به نام اندومتری که به صورت غیر طبیعی ضخیم شده است تعریف می شود که در آن شواهد بافتی دال برافزایش نسبت غدد به استروما وجود دارد وغدد به صورت کیستیک متورم شده و درجاتی از بی نظمی و برگشت به داخل و جوانه زدن هم در آنها دیده می شود هایپرپلازی کمپلکس،نشان دهنده تراکم غددی با استرومای اندک و وجود جوانه ها وبرگشت به منزله الگوی ساختمانی ساده یاکمپلکسی است که در آن سلول های مفروش نماینده غدد،قطبیت خود را از دست داده و هسته های بزرگی با افزایش نسبت هسته به سیتوپلنام دارند و هستک ها هم درداخل هسته واضح بود و کروماتین متراکم و نامنظم است.
از زمان مطالعه ای که از طریق Gusberg و Kaplan صورت گرفت، به بعد آنالیز های دیگربه تعدادی ازسوالاتی که در این زمینه وجود داشت پاسخ گفت .در یک مقاله مهم، Kurman و همکاران گزارش کردند که ریسک پیشرفت هایپرپلازی اندومتر به طرف کانسر برطبق زیرگروه هایپرپلازی متغیر است. در مطالعه ای بر روی 170 زن با هیپرپلازی درمان نشده اندومتر، 74% آنها به طور خودبخود برگشت پیدا کردند و 18% آنان بیش از ده سال به همان حالت باقی ماندند. خطر پیشرفت به سمت کانسر در بیماران با هایپرپلازی ساده، 0/01، در هایپرپلازی کمپلکس 0/03، در هایپرپلازی ساده باآتیپی 0/08 و در بیماران مبتلا به هایپرپلازی آدنوماتوز با آتیپی 0/029 است. علاوه بر اختلاف در پیش آگهی،انواع مختلف زیر گروههای هایپرپلازی اندومتر در توانایی پاسخ درمان پروژستینی جهت برگشت هایپرپلازی متفاوتند. Ferenczy و Gelfand نتایج درمان با پروژسترون را در 85 خانم یائسه مبتلا به هایپرپلازی اندومتر توضیح دادند. در بیمارانی که مبتلا به هایپرپلازی آتیپی بودند، متعاقب درمان با مدروکسی پروژسترون استات به میزان10
تا20میلی گرم روزانه، برگشت کامل بیماری وجود داشت، حال آنکه در صورت وجود آتیپی، تنها 50% پاسخ به درمان وجود داشت. همچنین در بیماران مبتلا به هیپرپلازی آتیپیک میزان عود هیپرپلازی و کانسر هم پس از تکمیل درمان پروژستینی افزایش داشت (50% درمقابل 6%).
درمان بالینی
درمان هیپرپلازی اندومتر بر طبق شرایط فردی هر بیمار فرق دارد و بستگی به معیارهای بافت شناسی،عوامل مستعد نماینده،سن بیمار و میزان تمایل وی به حفظ باروری درآینده دارد. در خانمهای قبل از سنین منوپاز،می توان از قرص های خوراکی جلوگیری از بارداری در صورت عدم وجود ممنوعیت قابل توجه، به مدت سه ماه استفاده کرد.بیشتر مطالعات پیشنهاد نماینده این است که کانسر، نهایتاً در حدود 20 تا 30 درصد از بیماران مبتلا به هایپرپلازی آتیپیک آدنوماتوز ایجاد خواهد شد، ولی در برخی از مطالعات، ریسکی حدود 82% در بیماران مبتلا به هایپرپلازی آتیپیک درمان نشده مطرح شده است. به نظر می رسد ریسک پیشرفت به سمت کانسر درخانمهای یائسه بیشتراز زنان قبل از سنین یائسگی است.طول زمانی میانه پیشرفت هایپرپلازی اندومتر در ضایعات بدون آتیپی به سمت کانسرحدود 10 سال است و این میزان در ضایعات همراه با آتیپی حدود 4 سال است. در بیماران مبتلا به هایپرپلازی آتیپیک که در یک نمونه بیوپسی آندومتر بدست آمده، باید جهت کنارگذاشتن احتمال وجود یک آدنوکارسینوم همراه یک D&C هم انجام شود. پیشنهاد شده که اگر داخل استرومای نمونه بدست آمده با کورتاژ ،اپی تلیوم غددی در داخل استروما دیده شود (تهاجم به استروما)، حتی اگر تشخیص هیپرپلازی باشد، خطر وجود یک کانسر اندومتر در داخل رحم بسیار زیاد است. اگر در بیوپسی اندومتر ویا بافت بدست آمده از D&C،تشخیص کارسینوم درجا (In situ) داده شود،تقریباً در همه موارد باید هیسترکتومی انجام شود، چرا که این تشخیص، درجه اطمینان بالایی ندارد و ممکن است در واقع نشان دهنده کانسر مهاجم درمراحل اولیه و یا یک خطای نمونه برداری باشد.در بیماران مبتلا به هیپرپلازی اندومتر بدون آتیپی،درمان پروژستینی در بازگرداندن این اختلال بسیار موثراست. در این بیماران هم می توان از درمان دوره ای و هم از درمان مداوم بهره گرفت که با استفاده از مدروکسی پروژسترون استات، 10 تا 20 میلی گرم روزانه یا مژسترول استات (Megace)، 20تا40 میلی گرم روزانه، برای 14روز در ماه یا تمام روزهای ماه صورت می گیرد. درمان باید تا 3ماه ادامه یابد و سپس باید جهت اثبات پاسخ به درمان نمونه برداری مجدد آندومتر صورت گیرد.در75 الی 90 درصد از بیماران درمان شده با پروژستین ها هیپرپلازی به سمت نرمال برخواهد گشت. در بیمارانی که خواهان بارداری هستند، القای تخمک گذاری با استفاده از کلومیفن یا منوتروپین ها (pergonal) صورت می گیرد. اگر خانمی خواهان باردار شدن نیست می توان از قرص های خوراکی جلوگیری از بارداری استفاده کرد. در بیمارانی که هیپرپلازی علی رغم درمان پابرجا باقی می ماند، قویاً پیشنهاد می شود که یک جراحی جهت درمان قطعی صورت گیرد.
اغلب بیماران مبتلا به هیپرپلازی آتیپیک، هنگامی که از خطر وجود یک آدنوکارسینوم همزمان (تقریباً 20% موارد) و پتانسیل پیش بدخیمی این ضایعه مطلع می شوند خود خواهان انجام یک هیسترکتومی و سالپنگواوفورکتومی دو طرف خواهند بود. دراین موارد یک خانم که واقعاً یائسه می باشد (آخرین قاعدگی بیمار2 سال پیش یا بیشتربوده است) باید قویاً تشویق شود تا تحت عمل هیسترکتومی قرار گیرد و درمان با پروژسترون را باید تنها در بیمارانی که به دلیل مسائل شدید طبی،کاندید خوبی برای عمل جراحی نمی باشند، در نظر گرفت. اگر باز هم تصمیم به درمان طبی بیمار داشته باشیم، درمان روزانه پروژسترون را باید برای 3 ماه در نظر گرفت و متعاقب آن نمونه برداری از آندومترانجام داد. اگر در این بیماران هایپرپلازی همچنان پابرجا بماند می توان جهت کنار گذاشتن احتمال وجود یک بدخیمی همزمان کورتاژ تشخیصی انجام داده و یا هیسترکتومی کرد در زمان عمل جراحی، رحم باید در اتاق عمل باز شود و در صورت لزوم از Frozen Section (نمونه منجمد بافتی) استفاده شود تا حضور و وسعت هرگونه بدخیمی احتمالی تعیین شده و در صورت وجود بدخیمی،مرحله بندی دقیق جراحی همزمان صورت گیرد.
یک نحوه درمان جالب که هنوز در مرحله تجربی است کارگذاشتن یک سیستم جلوگیری از بارداری پروژسترونی در داخل رحم است (ICPS) که به طور مداوم مقادیر درمانی پروژسترون یا لوونورژسترل را آزاد می کند. تا زمانی که
تجارب بیشتری از درمان با ICPS به دست نیاید، باید آن را تنها به نام یک روش تحقیقی در نظرگرفت.دو مطالعه مقدماتی اثر استفاده از دانازول (دانوکرین) را جهت درمان بیماران مبتلا به هایپرپلازی آدنوماتوز آنالیز کردند و درهر2 مطالعه تمام بیماران مداوا شده برگشت هایپرپلازی را در نمونه های مجدد آنالیز اندومترنشان دادند.تمام خانم های قبل از یائسگی در این مطالعه در عرض 1 تا 2 ماه پس از درمان،قاعدگی را از سرگرفتند. در مطالعه اول، تغییرات آتروفیک در نمونه برداری مجدد اندومتر علی رغم سطوح نرمال استرادیول در خون بیماران مشاهده شد که نشان دهنده اثر مستقیم دارو بر روی اندومتر بود.
یک ریسک فاکتور جهت بوجود آمدن هایپرپلازی اندومتر و کارسینوم آن که نسبتاً تازه شناخته شده است.استفاده از تاموکسی فن سیترات (Nolvadex) به نام یک درمان کمکی برای کانسر پستان می باشد.تاموکسی فن با افزایش حدود 2 الی 3 برابر در خطر کانسر اندومترو افزایش خطرهایپرپلازی اندومتر، پولیپ ها و رشد فیبروئیدها همراه است.درحال حاضر، بهترین طریقه پایش خانمهایی که تحت درمان تاموکسی فن قرار دارند ناشناخته است.آشکار است که بیماران باید یک امتحان بالینی سالانه لگن و پاپ نامیر سالانه داشته باشند. در صورتی که بیمار خونریزی غیر عادی رحمی داشته باشد باید نمونه برداری از اندومتر جهت وی انجام شود.ازآنجا که تاموکسی فن به نام یک استروژن ضعیف عمل می کند، منطقی است که بیوپسی سالانه از آندومتر یا آنالیز ضخامت 2 لایه اندومتر با سونوگرافی را در نظر داشت. با این وجود این توصیه،درحال حاضر بر مبنای مطالعات آینده نگر نیست بلکه بیشتر یک کار اجرا شده در انستیتوها می باشد.
بر اساس مطالعه ای که از طریق Uziely و همکاران صورت گرفت، زنانی که بیش از 12 ماه تاموکسی فن مصرف کردند، ریسک بالاتری جهت بوجود آمدن یک اندومتر ضخیم که همراه با یافته های غیر عادی در بیوپسی می باشد دارند. بر طبق مطالعاتی که تا امروز اجرا شده، سونوگرافی تنها جهت کنار گذاشتن احتمال یک پاتولوژی قابل ملاحظه در مواردی مفید است که ضخامت استریپ اندومترکمتراز 5 میلی متر است.
به طورخلاصه،درمان هیپرپلازی اندومتر باید به صورت مجزا و بر پایه یافته های بافتی و سن بیمار و هم علایق باروری وی در نظر گرفته شود. روش های درمانی شامل درمان هورمونی و جراحی است. با توجه به فرایند فزاینده مصرف تاموکسیفن، متخصص زنان باید از خطر تغییرات خوش خیم و بدخیم اندومتر مطلع باشد.
بدخیمی های رحم
کانسر اندومتر
کارسینوم اندومتر شایعترین بدخیمی دستگاه تناسلی زنان است، که تقریباً 7% از تمام کانسرهای زنان را شامل شده و حدود 31600 مورد تازه و 6300 مورد مرگ و میر در سال 1988 جهت آن تخمین زده شده است. در ایالات متحده، کانسر اندومتر درطول زندگی هر 45 زن در 1 نفر آنان ایجاد می شود.بیشتریت این تومورها آدنوکارسینوماتوز و هم سارکوماتوز دارند (تومورهای مختلط مولرین).میزان بروز کانسر اندومتر در طی 50 سال اخیر افزایش یافته است که به احتمال زیاد به علل زیر می باشد: افزایش میزان میانه امید به زندگی در جمعیت، افزایش فرکانس عوامل مستعد نماینده ای مثل چاقی و در دسترس قرارگرفتن متدهای پیشرفته تشخیصی.آدنوکار سینوم رحم، در اصل بدخیمی زنان یائسه است و با افزایش سن، قدرت بدخیمی آن افزایش می یابد. اوج شیوع سنی آن در زمان تشخیص آن افزایش می یابد. اوج شیوع سنی آن در زمان تشخیص بین 50 تا 65 سال است و تقریباً 25% از تمام موارد آن در خانمهای قبل از سنین یائسگی و 5% در خانم های زیر 40 سال تشخیص داده می شود. معمولاً، ولی نه همواره، این خانمها جوان یا چاق هستند و یا درمعرض عدم تخمک گذاری مزمن قرار دارند و یا هردوی این مسائل را همزمان دارند.
به نظر می رسد که 2 نوع مختلف کانسر اندومتر وجود دارد که یک نوع آن وابسته به استروژن و نوع دیگر غیروابسته به استروژن است. نوع اول بدخیمی به طور تعیین در زنان جوانتر و در حوالی سن یائگسی رخ می دهد که تاریخچه ای از قرار گرفتن در معرض استروژن را می دهند. این تومورها اغلب در نواحی هیپرپلاستیک ایجاد شده و تمایز یافته هستندو پیش آگهی در آنان رضایت بخش تر است. گروه دوم در زنان مسن تر بدون تحریک استروژنی اندومتر ایجاد شده و اغلب همراه با هایپرپلازی اندومتر نمی باشند و تمایز و پیش آگهی ضعیفی دارند.
عوامل خطر زا
عوامل خطر زا جهت ایجاد آدنوکارسینوم اندومترقرارگرفتن مزمن در معرض استروژن بدون رقیب چه با منشاء داخلی و چه خارجی است. به نظر می رسد چاقی، نازایی و منوپاز دیررس با سطوح بالای استروژن بدون رقیب با منشاء داخلی همراه هستند. در زنان چاق، تبدیل محیطی اندروستندیون به استروژن از طریق سلول های چربی افزایش می یابد. به نظر می رسد نازایی همراه رشد کانسراندومتر باشد،چرا که اختلال عملکرد تخمدان (سیکل های بدون تخمک گذاری مزمن و تخمدان های پلی کیستیک) هر 2 در ایجاد نازایی و استروژن بلامنازع شرکت دارند. در بیش از 25 درصد موارد،تومورهای ترشح نماینده استروژن مثل تومورهای سلول گرانولوزا همراه با کانسر اندومتر هستند. سایر عوامل خطرزا شامل تاریخچه رادیاسیون لگن،تاریخچه کانسر تخمدان یا پستان و استفاده از تاموکسی فن است.تشخیص
در حال حاضر هیچ روش پذیرفته شده غربالگر جهت تشخیص هیپرپلازی یا کانسر اندومتر در زنان بدون علامت وجود ندارد در مطالعات بالینی، بیوپسی روتین اندومتر، سونوگرافی ترانس واژینال و پاپ نامیر مورد ارزیابی قرار گرفته ولی هیچ یک از این تکنیک ها از دقت یا حساسیت کافی جهت استفاده در جمعیت عمومی برخوردار نیستند. هرچند یک پاپ نامیر روتین نمی تواند به نام یک روش غربالگری کانسر اندومتر مورد نظر قرار گیرد،با این وجود باید احتمال وجود این بدخیمی را درهرخانم غیرباردار با سلول های آتیپیک اندومتر در پاپ نامیر دارند مد نظر داشت.خونریزی غیر عادی رحم شایعترین علامت کلینیکی کانسر اندومتر است. هر نوع خونریزی در یک زن یائسه باید دقیقاً ارزیابی شود، هرچند تنها حدود 20% از این بیماران مبتلا به یک بدخیمی دستگاه تناسلی هستند. احتمال اینکه خونریزی بعد از منوپازنشانگر وجود یک کانسر رحم باشد به
وضوح با افزایش سن افزایش می یابد. زنانی که درسنین حوالی یائسگی قرار دارند و مبتلا به خونریزی غیر عادی رحم هستند هم باید تحت آنالیز قرار گیرند و بیشترین الگوهای خونریزی در آنان افزایش میزان خونریزی قاعدگی، کاهش فواصل بین قاعدگی و خونریزی بین قاعدگی هاست. در صورت امکان، آنالیز اندومتر باید از طریق یک بیوپسی در مطب انجام شود که در شرایط مطلوب، دقتی برابر با یک D&C معمولی دارد(تقریباً 90%). کورتاژ اندوسرویکال (ECC) باید همواره جهت آنالیز خونریزی های پس از یائسگی جهت کنارگذاشتن احتمال وجود کارسینوم اندوسرویکس به نام دلیل خونریزی انجام شود. اگر بیوپسی اندومتر و ECC رضایت بخش باشند (و بافت کافی جهت تشخیص حاصل شود) و هیچ نکته غیر عادی به اثبات نرسد نیاز به آنالیز بیشتری وجود ندارد.اگرخونریزی بعد ازمنوپاز باقی بماند یا عود کند و یا سایر فاکتورهای خطرزا وجود داشته باشند حتماً باید یک D&C انجام شود. فاکتورهای خطرزا شامل هایپرپلازی آتیپک یا پولیپ های آندومتر هستند.اگرخونریزی عود کند یا شک به وجود پولیپ با فیبروئیدهای زیر مخاطی داشته باشیم باید هیستروسکوپی را مد نظر داشت. بسکمک از مطالعات کلینیکی در حال حاضر،سودمندی استفاده از سونوگرافی واژینال را برای آنالیز ضخامت اندومتر در بیماران مبتلا به خونریزی پس از یائسگی به اثبات رسانده اند. مطالعات متعددی پیشنهاد نماینده این بوده است که اگر ضخامت دو لایه اندومتر کمتر از پنج میلی متر باشد،دلیل خونریزی معمولاً اتروفی است، ولی گزارشات نادری هم وجود بدخیمی که با بیوپسی ثابت شده را حتی در بیمارانی با اندومتر نازک نشان داده است.
اگرآدنوکار سینوم آندومتر تشخیص داده شود، قبل از تصمیم در مورد نحوه درمان باید در صورت لزوم آنالیز بیشتری انجام داد تا بهترین نوع درمان تعیین شود. یک معاینه فیزیکی دقیق باید انجام شود و توجه خاص به لنف توده های اینگوینال و سوپراکلاویکولار مبذول شود.با معاینه شکم و معاینه دو دستی رکتوواژینال، و میزان تحرک رحم،سایز و قوام سرویکس، آدنکس ها و پارامترها و تمام واژن،ولو و رکتوم جهت یافتن هرگونه ندول،توده، سفتی و ضایعات شبیه به پلاک که ممکن است نشان دهنده بیماری مناستاتیک باشند آنالیز می شود. ازهرگونه ضایعه مشکوک تناسلی باید بیوپسی به عمل آید و امتحان مدفوع از نظر آنالیز خون مخفی انجام شود.زیر گروه بافت شناسی و درجه تومور با بیوپسی اندومتر یا نمونه D&C تعیین شده ولی مهم است به خاطر داشته باشیم که تقریباً در 1/3موارد، درجه بدخیمی نهایی تومور که درنمونه بافت هیسترکتومی بدست می آید با بیوپسی اولیه اندومتر و D&C فرق دارد. مطالعات اضافی که باید انجام شود شامل عکس دو بعدی قفسه سینه و آزمایشات روتین است. بسته به سایر علائم و فاکتورهای خطرزا، ممکن است انجام باریم انما یا کولونوسکوپی و MRI قبل از عمل جهت ارزیابی رحم از لحاظ عمق تهاجم و اثبات بیماری متاستاتیک مخفی لازم باشد. یک تست اضافی که گزارش شده می تواند عامل پیشگویی نماینده پیروزی جهت تخمین عمق تهاجم به میومتر یا متاستاز دور دست باشد، میزان گیری شاخص توموری سرمی CA125 می باشد. مطالعات متعددی اثبات نموده است که 53% الی 87% از بیماران در مرحله I بالینی که در زمان عمل، تعیین می شود که بیماری به خارج رحم پیشرفته است سطوح افزایش یافته CA125 سرمی دارند، حال آنکه این میزان در بیمارانی که در زمان عمل جراحی هم در مرحله I واقعند تنها 2 تا 12 درصد است. اگر تصمیم جهت مرحله بندی کامل جراحی در زمان عمل گرفته شود (یعنی اگر جراح مهارت کافی جهت انجام لنفادنکتومی لگنی و پاراائورتیک،درصورت لزوم، داشته باشد) ممکن است نیاز به این آزمایشات روتین نباشد.
از آنجا که در حال حاضر کانسر اندومتر در مقایسه با روش قدیمی مرحله بندی کلینیکی، به صورت جراحی طبقه بندی می شود، باید نکات خاص متعددی را مد نظر قرار داد، در گذشته، در بسکمک از بیماران، به خصوص آنها که مبتلا به ضایعات درجه II یا III بودند، نتیجه کورتاژ اندوسرویکس (ECC) در آنها مثبت بود و یا رحم بزرگی داشتند از رادیوتراپی قبل از عمل استفاده می شد.بسته به محل بیماری،یا سزیوم داخل حفره ای برای تقریباً 72 ساعت و یا استفاده از رادیاسیون خارج لگن به میزان 4000تا 4500 cGy باشد. با استفاده از این متدهای درمانی، بسکمک از بیماران یا رادیاسیون غیر ضروری دریافت می نمایند و یا رادیاسیونی می گیرند که نمی تواند تمام منطقه ها بیماری آنها را پوشش دهد (برای مثال، لنف نودهای پاراآئورتیک).
یک متد دیگراین است که تمام بیماران باید حداقل تحت یک مرحله بندی کامل جراحی، شامل برداشتن انتخابی لنف نودهای لگنی و پاراآئورتی قرارگیرند. با انتخاب متد مرحله بندی تازه جراحی (به زیر مراجعه شود)، بیشتربیماران باید تحت درمان اولیه جراحی قرارگیرند که شامل یک هیسترکتومی، سالپنگواووفورکتومی دو طرفه، سیتولوژی پریتوان و درصورت لزوم برداشتن انتخابی لنف نودهای لگن و پاراآئورتیک می باشد.
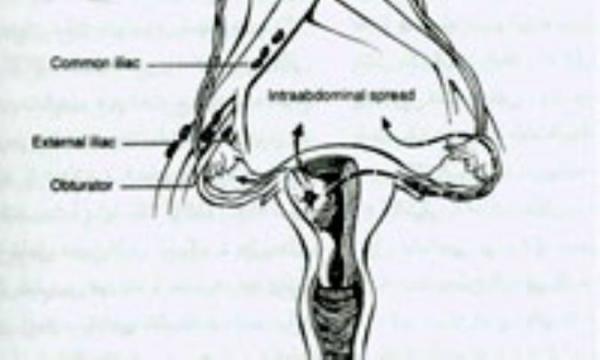
از آنجایی که کانسر اندومتر می تواند هم از طریق لفناتیک و هم از راه جریان خون و همچنین ازطریق دیواره های رحم و یا لوله های رحمی به حفره پریتوان انتشار یابد (شکل 7)،جهت اثبات وجود هرگونه متاستاز خارج رحمی باید آنالیز کامل تمام حفره شکم انجام شود.انجام رادیوتراپی اولیه باید تنها در بیمارانی که به لحاظ تکنیکی غیر قابل عمل هستند و یا مسائل طبی ای دارند که آنها را کاندیداهای خوبی جهت عمل نمی کند در نظر گرفته شود در این بیماران،باید مرحله بندی بیماری از طریق بالینی و با توجه به متد قدیمی مرحله بندی بالینی صورت گیرد.
عوامل تعیین نماینده پیش آگهی
فاکتورهای شناخته شده متعددی جهت پیش گویی پیش آگهی بیماران مبتلا به آدنوکارسینوم اندومتر وجود دارند.این فاکتورها جهت انتخاب درمان مناسب برای این بیماران هم ارزشمند می باشند.مرحله بندی
تا اواخردهه 1980، کانسر اندومتراز طریق بالینی و با توجه به اطلاعات بالینی که از معاینه بیمار و D&C بدستمی آمد مرحله بندی می شد. با این وجود، این سیستم مرحله بندی، پیروز به تشخیص عوامل پیشگویی نماینده مهم مانند تهاجم عمقی میومتر و بیماری مخفی خارج رحم نبود و اغلب وسعت بیماری را کمتر از میزان واقعی برآورد می کرد.به دلیل این ضعف ها،فدراسیون بین المللی زنان و مامایی (FIGO)این سیستم طبقه بندی را در سال 1988 تغییر داد تا اطلاعات حاصل از آنالیز جراحی و پاتولوژی بافت بدست آمده را هم در یک سیستم تازه مورد نظر قرار دهد.امروزه ،کانسر اندومتر بر اساس سیستم مرحله بندی تازه FIGO مرحله بندی می شود. در حال حاضر توصیه می شود تمام بیماران که با درمان طبی قابل معالجه اند و در مرحله I بیماری واقعند.بدون توجه به درجه بدخیمی تومور،تحت یک هیسترکتومی کامل خارج فاسیایی از راه شکم و سالپنگواووفورکتومی دو طرفه هم به منظور مرحله بندی بیماری و هم درمان آن واقع شوند. برش دیواره شکم باید به میزان کافی وسیع باشد تا با توجه به درجه بدخیمی تومور و عمق تهاجم به میومتر در صورت لزوم، اجازه نمونه برداری از لنف نودهای لگنی و پاراآئورتی را به جراح بدهد. بلافاصله پس از ورود به حفره پریتوان، باید مایع (مایع آسیت یا شستشوی پریتوان) جهت آنالیزسیتولوژیک برداشته شود.
علی رغم اینکه سیستم طبقه بندی جراحی FIGO در حدود 10 سال است که مورد استفاده قرار می گیرد،هنوز اختلاف نظر قابل ملاحظه ای درمورد اینکه کدام بیمار باید تحت نمونه برداری قرار گیرد وجود دارد. همچنین هنوز روشن نیست که چگونه باید این بیماران را انتخاب کرد و کدام یافته های قبل از عمل و حین عمل می توانند جهت تعیین جمعیتی از بیماران که با احتمال بیشتری از این روش سود می برند به کار گرفته شوند. بسکمک از پزشکان، در حین عمل از تشخیص با انجماد بافتی (Frozen section) و نظر پاتولوژیست در مورد درجه بدخیمی و عمق تهاجم جهت تصمیم گیری برای انجام مرحله بندی کامل جراحی استفاده می نمایند. بقیه پزشکان، از اطلاعات بدست آمده از نمونه های بیوپسی اندومتر و اطلاعات رادیوگرافیک، به خصوص زمانی که بیمار را باید به یک مرکز مخصوص مرحله بندی جراحی ارجاع داد استفاده می نمایند.
در یک مطالعه بزرگ که از طریق گروه ژنیکولوژی - انکولوژی (GOG) بر روی 612 زن مبتلا به مرحله I بالینی تومور اندومتر اجرا شده، تعیین شد که 22% بیماران بیماری خارج از رحم داشتند. محل بیماری دور دست،نهایتاً یا درلنف نودهای پاراآئورتی و لگنی ویا سیتولوژی مثبت پریتوان بود.احتمال درگیری آدنکس ها کمترازلنف نودها یا سیتولوژی مثبت پریتوان بود.همچنین مهم است بدانیم که در یک مطالعه دیگر ثابت شد که تنها 24% از بیماران که از لحاظ بالینی در مرحله II بیماری واقع بودند،عملاً در زمان هیسترکتومی درگیری ثابت شده پاتولوژی سرویکس داشتند. ندرتاً برخی از بیماران مبتلا به کانسرهمزمان اندومتر و تخمدان با شیوعی حدود 1/4 تا 3/8 درصد می باشند. هرچند افتراق بین بیماری متاستاتیک و کانسر اولیه همزمان در تخمدان و رحم معمولاً در ارزیابی معمول پاتولوژی میسراست، در موارد نادر ممکن است این افتراق چندان اطمینان بخش نباشد.
درجه بدخیمی توموری
درجه بدخیمی تومور،میزان مهاجم بودن آن را تعیین می کند و امروزه به نام یک بخش ضروری از سیستم مرحله بندی FIGO جهت کانسر اندومتر به تعداد می رود. درجه بدخیمی تومور یکی ازمهمترین عوامل پیشگویی نماینده جهت میزان بقای کلی است. برآورد درجه تومور بر پایه معیارهای آناتومیک مثل شکل غدد و آتیپی هسته است وبه طرز قابل ملاحظه ای بسته به دید پاتولوژیست می باشد. همچنین غیر متداول نیست که درجه تومور که از بیوپسی اندومتر به دست آمده با درجه نهایی تعیین شده در بافت بدست آمده از هیسترکتومی متفاوت باشد.هرچقدر درجه تومور بالاترباشد،احتمال تهاجم عمقی میومتر و متاستاز به غدد لنفاوی و سایر متاستازها بیشتراست.زیرگروهای بافت شناسی
زیرگروهای بافت شناسی آدنوکارسینوم ممکن است به نحو مستقلی روی پیش آگهی بیمار موثر باشند. تقریباً 80% از کانسرهای اندومتر از نوع آندومتروئید هستند و 15 الی 25% از این تومورها تحت تمایز سنگفرشی قرار می گیرند. اهمیت تمایز سنگفرشی تعیین نیست و اثر آن،سالها مورد شک بوده است. در گذشته از واژه های آدنواکانتوم و کارسینوم آدنواسکواموس جهت تعیین نمودن آدنوکارسینوم با تمایز سنگفرشی خوش خیم یا بدخیم استفاده می شد. اخیراً، Zaino و همکاران پیشنهاد کردند که این واژه ها با اصطلاح دقیق تر آدنوکارسینوم با تمایز سنگفرشی جایگزین شوند. در مقایسه با آدنوکارسینوم آندومتروئید، کانسرهای پاپیلاری سروز و سلول شفاف آندومتر بسیارنادر هستند (تقریباً باشیوع 5%) ولی پیش آگهی بسیار بدتری دارند. هر دو این نوع کانسرها در زنان پیرتر دیده شده و اغلب حتی هنگامی که از لحاظ بالینی در مرحله I هستند،متاستاز دور دست داده اندسن
هرچند به وضوح تشخیص داده شده که افزایش سن بیماران در زمان تشخیص با یک پیش آگهی ضعیف تر همراه است،هیچ توافقی در مورد دلیل این مسئله وجود ندارد در یک مطالعه از طریق Lurain و همکاران، افزایش سن بیمار یک فاکتور مستقل جهت پیش آگهی بود که با بیماری راجعه در ارتباط بود. درمقایسه با 12% عود در زنان بین 50 تا 75 سال سن و 33% عود در زنان بالاتر از 75 سال،هیچ عودی در بیماران زیر 50 سال مشاهده نشده.به ازای هر 1 سال افزایش سن بالای 50 سال،7% افزایش در میزان عود وجود داشت.در مقایسه با بیماران مسن، بیماران جوانتر ضایعات خوب تمایز یافته و در مراحل اولیه بدون تهاجم و یا با تهاجم اندک به میومتر دارند.از طرف دیگر شرایط عمومی سلامتی در بیماران جوانتر بهتر بوده و بنابراین جراحی های تهاجمی درمانی را بهتر تحمل می نمایند. همچنین گزارش شده که زنان پیرتر بیشتر امکان دارد علائم خونریزی غیر عادی واژینال را مورد غفلت قرار دهند و بنابراین تشخیص بیماری تا مراحل پیشرفته به تاخیر می افتد.هرچند جالب است بدانیم که فاصله زمانی بین آغاز خونریزی و مراجعه به پزشک با مرحله تومور ارتباط نداشته و لزوماً بیماران مبتلا به مراحل پیشرفته بیماری تأخیر در مراجعه پزشکی نداشته اند.نژاد
حتی در صورت تصحیح سن و مراحل تومور، زنان سیاه پوست مبتلا به کانسر اندومتر، پیش آگهی بسیار ضعیف تری نسبت به زنان سفید دارند. برای تمام مراحل بیماری میزان بقای 5 ساله در زنان سفید 86/5% در مقابل 55/5% یعنیمیزان بقای 5 ساله زنان سیاه پوست است و درهرمرحله از بیماری، میزان بقای نسبی در سیاه پوستان پایین تر است.
عمق تهاجم به میومتر
یک فاکتور موثر دیگر در پیش آگهی که به طور مستقیم با احتمال وجود بیماری خارج رحمی در ارتباط است،عمق تهاجم به میومتر می باشد. در سیستم تازه مرحله بندی جراحی، ماکزیممم عمق تهاجم به میومتر زیرگروه بیماری را در مرحله I آن تعیین می کند. پژوهشگران معتقدند که با افزایش عمق تهاجم،احتمال دسترسی به سیستم لنفاتیک افزایش یافته و بنابراین احتمال بروز متاستاز لنف نودهای لگنی و پاراآئورتیک هم بیشتر می شود. دریک مطالعه از طریق Boronow و همکاران تعیین شد که تنها یک درصد از بیماران بدون تهاجم به میومتر درگیری لنف نودهای لگنی داشتند،حال آنکه این میزان در کسانی که 1/3 خارجی میومتر درآنها درگیر بود به 25% بالغ می شد.همچنین به نظر می رسد میزان بقاء تحت تاثیرعمق تهاجم قرار گرفته است،چنانچه میزان بقای 5 ساله در تهاجم مختصر به میومتر 80 تا 0/090 در مقایسه با 0/060 میزان بقا درصورت وجود تهاجم عمقی است.سیتولوژی پریتوان
در مورد اهمیت بدخیم پریتوان که در طی مرحله بندی جراحی کانسراندومتر به دست آمده،اختلاف نظر وجود دارد در تقریباً تمام مطالعات اجرا شده،یک نتیجه سیتولوژی مثبت پریتوان همراه با سایر عوامل خطرزا از جمله تهاجم عمقی به میومتر،انتشار به آدنکس ها، متاستاز به غدد لنفاوی و درگیری سرویکس است. در مطالعات متعددی نشان داده شده که ریسک عود بیماری در بیمارانی که سیتولوژی پریتوان مثبت دارند دو تا سه برابر می شود ولی اغلب این بیماران عوامل خطرزای دیگری هم داشته و در خیلی از موارد عود بیماری در خارج از حفره پریتوان روی می دهند. دربیمارانی که سیتولوژی مثبت دارند، تعیین نیست که درمانهایی که در حال حاضر در دسترس می باشند هیچ اثری بر پیش آگهی نهایی داشته باشند.متاستاز عقده های لنفاوی
در بیماران مبتلا به کانسر آندومترکه از نظر بالینی در مرحله I هستند، وجود درگیری در عقده های لنفاوی، مهمترین فاکتور مستقل پیش گویی نماینده بوده و همراه با شش برابر افزایش خطر عود بیماری می باشد. در این بیماران در مرحله I بالینی کانسر، تقریباً در 0/010 موارد درگیری عقده های لنفاوی لگن وجود دارد و 0/060 هم درگیری عقده های لنفاوی اطراف آئورت دارند و درگیری عقده های لنفاوی اطراف آئورت مهمترین عامل پیشگویی نماینده بقاست. میزان درگیری عقده های لنفاوی با مرحله و درجه بدخیمی توموردر ارتباط مستقیم بوده و همچنین با عمق درگیری میومتر و محل کانسر در رحم (برای مثال درگیری فوندوس در مقابل درگیری سگمان تحتانی رحم) مرتبط است. در بیماران مبتلا به مرحله II بیماری، متاستاز به غدد لنفاوی در تقریباً 0/035موارد رخ می دهد.درگیری آدنکس ها در داخل پریتوان
متاستاز به آدنکس ها که از لحاظ بالینی، مخفی می باشد در تقریباً 0/010 از بیماران در مرحله I بیماری رخ می دهد و بیشتر این بیماران سایرعوامل خطرزا مانند تهاجم عمقی به میومتر یا درگیری عقده های لنفاوی را هم دارند. در بیمارانی که تنها فاکتورخطرزای آنان متاستاز به آدنکس هاست،میزان کلی بقا به نظر می رسد که چندان تحت تاثیر این عامل قرار ندارد. سایر متاستازهای خارج رحم و داخل پریتوان با کاهش قابل ملاحظه ای در طول عمر بیمار همراهند.سایر عوامل
بسکمک از فاکتورهای دیگر هم شناخته شده اند که به نظر می رسد پیش آگهی را تحت تاثیر قرار دهند،این عوامل شامل: شرایط گیرنده های هورمونی تومور، محتویات DNA یا پلوئیدی آن، شاخص پرولیفراسیون و بیان انکوژن ها می باشند. نشان داده شده که هم سطح گیرنده های استروژن و هم پروژسترون عوامل مستقلی در تعیین پیش آگهی بدون توجه به درجه بدخیمی تومورهستند و سطح گیرنده های پروژسترون عامل مهمتری جهت تعیین میزان کلی بقاست. سطح گیرنده های پروژسترون همچنین جهت پیش گویی اینکه کدامیک از بیماران مبتلا به بیماری پیشرفته یا راجعه بیشترین احتمال پاسخ به درمان هورمونی را دارند به کار می رود.درمان
درمان اولیه کانسراندومتر جراحی است که شامل برداشتن رحم، سرویکس و ساختمان ادنکس هاست. همانطور که قبلاً توضیح داده شد، مرحله بندی دقیق جراحی شامل تجسس کامل شکم و لگن و لنفادنکتومی اغلب به طور همزمان انجام می شود.به محض اینکه رحم خارج شد باید جهت انجام Frozen Section به آزمایشگاه پاتولوژی فرستاده شود تا درجه بدخیمی آن و عمق تهاجم تعیین شده و همچنین از نظر میزان گیرنده های استروژن و پروژسترون و سایر مطالعات لازم آنالیز شود. در بیمارانی که در آنها نمونه برداری از لنف نودها لازم است. بافت حاوی لنف نودها، ازقسمت پایین آئورت و ورید اجوف برداشته می شود. جهت نمونه برداری از لنف نوده های لگن باید آنها را از جهت ایلیاک مشترک و خارجی و ابتوراتور بدست آورد.ممکن است نیاز به انجام بیوپسی از امنتوم داشته باشیم که در بیماران مبتلا به کانسر سلول روشن و پاپیلری سروز جایز است. در بیمارانی که کاندیداهای بسیار ضعیف انجام لاپاراتومی تجسسی هستند (برای مثال بیماران بسیارچاق) می توان انجام هیسترکتومی واژینال یا هیسترکتومی واژینال با کمک لاپاراسکوپی را درنظر گرفت.باید حتی الامکان ساختمان آدنکس ها را خارج نمود و بنابراین هیسترکتومی از راه واژن با کمک لاپاراسکوپ متد خوبی است. اگر جراحی مهارت کافی داشته باشد، مرحله بندی کامل جراحی،شامل لنفانکتومی لگن و اطراف آئورت را می توان از طریق لاپاراسکوپ انجام داد.تا هنگامی که اطلاعات کافی بدست نیامده، انجام هیسترکتومی واژینال باید تنها به بیماران بسیار انتخابی محدود شود که ممکن است در غیر این صورت تنها از درمان با رادیاسیون سود جویند.در بیمارانی که درگیری واضح سرویکس در آنها از لحاظ بالینی هم قابل تشخیص است باید انجام هیسترکتومی رادیکال و سالپنگواووفورکتومی دو طرفه و برداشتن غدد لنفاوی را مد نظر داشت.
متعاقب جراحی و خواندن گزارش نهایی پاتولوژی،بیماران را می توان بر اساس عوامل پیش آگهی که در بالا مورد بحث قرار گرفته به گروههای کم خطر و پرخطر تقسیم کرد و براساس این تقسیم بندی می توان در صورت لزوم،درمان پس از عمل را جهت بیماران در نظر گرفت.از آنجاکه تنها کمتر از 10 سال است که مرحله بندی جراحی کارسینوم اندومترعملاً مورد استفاده قرار گرفته،امروزه بیشتر اطلاعات جهت توصیه رادیوتراپی پس از عمل براساس متد قدیمی مرحله بندی بالینی بیماران است. خطر عود لگنی در بیماران پرخطر در هنگامی که عدم درگیری لگن در مرحله بندی جراحی وجود دارد ناشناخته است. مطالعات GOG براساس ارتباطات جراحی - پاتولوژی تعیین نموده که حتی وقتی لنف نودهای انتخابی منفی هستند بیماران مبتلا به تهاجم عمقی میومتر و کانسرهایی با تمایز ضعیف در معرض بالایی از خطر عود بیماری قرار دارند. حتی اگر مرحله بندی جراحی در اثبات بیماری خارجی رحمی در لگن پیروز نباشد، انجام رادیوتراپی پس از عمل با کاهش ریسک عود موضعی همراه است.هنوز روشن نشده که آیا مرحله بندی جراحی می تواند زیر گروهی از بیماران مرحله I را (غیر از سایر بیمارانی که تا به امروز در گروه کم خطر قرار گرفته اند) تعیین کند که نیازی به درمان کمکی با رادیاسیون دارند، یا خیر.
درمان بیماران در مرحله II بیماری هنوز مورد اختلاف نظر است.بیشتر مطالعات پیشنهاد نماینده این است که بیماران با درگیری سرویکس در معرض ریسک افزایش یافته عود در گنبد واژن هستند و اغلب نیازمند درمان کمکی رادیاسیون گنبد واژن هستند و اغلب نیازمند درمان کمکی رادیاسیون گنبد واژن می باشند.اینکه آیا این بیماران که مرحله بندی جراحی درآنها منفی است،به رادیاسیون لگن هم علاوه بر گنبد واژن نیاز دارند یا خیر هنوز تعیین نشده است.درصورتی که درگیری واضح بالینی سرویکس وجود داشته باشد،توصیه درمانی شامل هیسترکتومی رادیکال یا رادیوتراپی قبل از عمل و در پی آن هیسترکتومی اکسترافاشیال است.
درمان بیمارانی که بیماری ثابت شده خارج رحم دارند (مرحله III و IV) باید با توجه به تعیین نمودن وسعت بیماری صورت گیرد.اهداف درمانی شامل رادیاسیون لگن، رادیاسیون با دامنه توسعه جهت پوشش دادن لنف نودهای اطراف آئورت، رادیاسیون تمام شکم، و درمان هورمونی سیستمیک یا شیمی درمانی است. در بیشتر موارد،درمان متاستازهای دور دست با دوز بالای پروژستین ها و یا شیمی درمانی تنها نقش تسکین دهنده داشته و امید به بقا در این بیماران بسیار پایین است.عوامل شیمی درمانی که در این موارد به طور گسترده مورد استفاده واقع شده اند شامل: داکسوروبیسین هیدروکلراید (آدریامایسین) و سیس پلاتین (پلاتینول) یا کاربوپلاتین (پاراپلاتین) می باشند.
سالهاست که از پروژستین ها در درمان عود کانسراندومتراستفاده شده و تقریباً 1/3 از بیماران پاسخ رضایت بخشی به این درمان می دهند.بیمارانی که تومور تمایز یافته دارند میزان پاسخ بالاتری نسبت به آنها که تمایز تومورآنها میانه یا ضعیف است به درمان می دهند.هرچند، هنوز نقش گیرنده های استروژن و پروژسترون در درمان کانسر اندومتر به طور گسترده مورد قبول عموم واقع نشده است، به نظر می رسد که پاسخگویی عود تومور به درمان پروژستین بستگی به میزان گیرنده های استروژن و پروژسترون دارد. اگر هر 2 نوع گیرنده وجود داشته باشند، احتمال یک پاسخ رضایت بخش به درمان بدون توجه به درجه بدخیمی تومور یا سایر عوامل خطرزا بسیار بالا خواهد بود. اگر تراکم گیرنده ها پایین باشد،احتمال اینکه تومور به هنگام عود به پروژستین ها پاسخ دهد بسیار ضعیف بوده وباید انجام شیمی درمانی را در این موارد در نظر گرفت.
تقریباً 10 الی 15درصد از بیماران مبتلا به کانسر اندومتر به دلیل چاقی شدید یا بیماری شدیداً ناتوان نماینده قابل عمل نیستند، در این بیماران باید درمان اولیه با رادیاسیون را مد نظر قرار داد. دربیشتر موارد،ترکیبی از رادیاسیون خارجی و داخل حفره ای باید استفاده شود و با
درمان کامل، تقریباً 85 الی 90درصد از بیماران در مراحل اولیه بیماری با این تکنیک کنترل خواهند شد.ریسک کلی عود بیماری در این بیماران در مرحله I بستگی به درجه بدخیمی تومور دارد و این مرحله میزان بقای 5 ساله 94% برای تومور درجه I، 0/092 برای درجه II و 78% برای تومورهای درجه III است.
پیگیری بیماران پس از درمان
بسکمک از مطالعات ثابت نموده اند که بیشتریت عودهای پس از درمان کانسر اندومتر در عرض 3 سال اول رخ خواهند داد. تقریباً 1/3 این عودها بدون علامت بوده و بنابراین توصیه رایج این است که بیماران در 2-3 سال اول هر 3-4 ماه با معاینه فیزیکی و سیتولوژی واژن پی گیری شوند و پس از آن برای حداقل 5 سال هر 6 ماه تحت معاینه و انجام ستیولوژی قرار گیرند.میزان گیری سریال CA125 سرم هم در پی گیری پس از درمان بیماران پیشنهاد شده،ولی میزان آن ممکن است در مراحل اولیه عود بیماری طبیعی باشد. با اینکه، کانسر درمان شده اندومتر در بیشتریت بیماران عود نخواهد کرد، با این حال، مطالعات متعددی به ارزشمندی این متد پیگیری بیماران اشاره نموده اند. در یک مطالعه که از طریق مرکز کانسر دکتراندرسون (M.D. Anderson Cancer Center) صورت گرفت، 59% از عودها بدون علامت بوده و بیش از 1/3 آنها در هنگام معاینه فیزیکی کشف شدند، 26% به واسطه افزایش CA125 وتنها 0/04 به کمک سیتولوژی واژن تعیین شده بودند. به واسطه این یافته ها، این مولفان توصیه کردند که در بیماران بدون علامت، معاینه فیزیکی،میزان گیری CA125 سرم و سیتولوژی واژن تنها هر دوازده تا شش ماه انجام شود. در یک مطالعه در کانادا،گزارش شد که در طی بیش از 200 مورد پیگیری و روتین بیماران پس از درمان کانسر اندومتر که در سال اول ویزیت هر سه ماه یک بار، در سال دوم هر4ماه یکبار و پس از آن هر 6 ماه یکبار انجام شد،هیچ تفاوتی بین موارد عود کشف شده درطی این ویزیت های روتین بیماران بدون علامت در مقایسه با میزان عود بیماری در بیماران علامتدار مشاهده نشد. دراین مطالعه هیچ مورد عودی تنها به کمک سیتولوژی واژن کشف نشد. در مطالعه سومی که در دانشگاه Duke صورت گرفت، یک آنالیز از تکنیک های مختلف پی گیری ثابت کرد که انجام سیتولوژی روتین واژن و عکس قفسه صدری از بیماران مقرون به صرفه نیستند. توصیه این محققین این است که بیماران هر 6 ماه فقط با معاینه فیزیکی پیگیری شده و هر گونه آزمایش اضافی تنها جهت آنالیز علائم ایجاد شده انجام شود.درمان جایگزینی استروژن پس از درمان کانسر
سالها تصور می شد که وجود تاریخچه مثبت کانسر اندومتر، هر چند که با پیروزیت درمان شده باشد، یک ممنوعیت مطلق جهت درمان جایگزینی استروژن ایجاد می کند چرا که تصور می رود آدنوکارسینوم اندومتر یک نئوپلنام وابسته به استروژن است. از آنجا که در حال حاضر هیچ گونه اطلاعات علمی موید خطرناک بودن ERT در بیمارانی که به دلیل کانسر اندومتر هیسترکتومی شده اند وجود ندارد و به دلیل اینکه بیشتریت شواهد به نفع تایید سودمندی ERT در کاهش عوارض و مرگ و میر ناشی از بیماریهای قلبی،سکته مغزی، و پوکی استخوان است،بسکمک از پزشکان و بیماران دیدگاههای اولیه را زیر سوال برده اند، در اواخر دهه گذشته مطالعات کوچک گذشته نگر متعددی در مورد درمان با ERT پس از درمان کانسراندومتر در مراحل اولیه صورت گرفت.درسال 1986، Creasman و همکاران 221 بیمار را پس از مداوای مرحله I کانسر اندومتر تحت نظر گرفتند و 47 نفر آنان (0/021)پس از عمل تحت درمان استروژن به مدت 26 ماه واقع شدند. پس از یکسان کردن دو گروه از بیماران با توجه به درجه بدخیمی تومور، تهاجم به میومتر، متاستاز به غدد لنفاوی، سیتولوژی پریتوان و سن،آنالیز آماری هیچ افزایش ریسک عود یا مرگ و میری را در کسانی که ERT شدند در مقایسه با آنان که ERT نشدند نشان نداد.درحقیقت ریسک عود بیماری به طور قابل ملاحظه ای در گروه درمان نشده بالاتر (15% در مقابل 2%) و همچنین ریسک مرگ و میر به دلیل بیماری فعال در آنها بیشتر بود.3 سال بعد، Lee و همکاران مطالعه مشابهی را با نتایج مشابه گزارش کردند.در هر دوی این مطالعات ممکن است خطای انتخاب بیماران در ایجاد نتایج موثر باشد ولی به نظر می رسد که می توان گروه کم ریسکی از بیماران را انتخاب کرد که بتوانند به طور بی خطری درمان جایگزینی استروژن را دریافت نمایند. Chapman و همکاران،دریک مطالعه گذشته نگر برروی 123 بیمار مبتلا به مرحله Iو III کانسر اندومتر که 62 نفر آنان ERT دریافت نموده بودند،هیچ افزایشی را در عود یا مرگ و میر ناشی از بیماری گزارش نکردند. دریک کمیته بازنگری در اگوست 1993؛ کالج امریکایی زنان و مامایی خاطر نشان کرد که در حال حاضر اطلاعات قطعی جهت حمایت از یک توصیه خاص درمورد استفاده از ERT در زنانی که قبلاً تحت درمان کانسر اندومترقرار گرفته اند، وجود ندارد.نظراین کمیته این بود که استروژن را می توان با اندیکاسیون هایی مشابه هر زن دیگر، در این بیماران مورد استفاده قرار داد، مشروط بر اینکه انتخاب کاندیداهای مناسب بر پایه عوامل موثر در پیش آگهی و میزان ریسکی که بیمار مایل به تقبل آن است صورت گیرد. به دلیل محدودیت اطلاعات،لزوم استفاده از پروژسترون علاوه براستروژن را در حال حاضر نمی توان برآورد و توصیه نمود.
سایر بدخیمی های رحم
سارکوم های رحم نادر بوده و تنها 3تا 5 درصد از تمام بدخیمی های رحم را شامل می شوند.این ضایعات به طور اولیه از دو محل منشاء می گیرند: سارکوم اندومتر از غدد واسترومای اندومتر و لیومیوسارکوم از خود بافت میومتر.سایر سارکوم ها مانند آنژیوسارکوم و فیبرسارکوم از بافت های نگه دارنده منشاء می گیرند. به طور کلی سارکوم های رحم بدخیم ترین نوع تومورهای رحم هستند و از لحاظ الگوی انتشار و پیش آگهی به طرز قابل ملاحظه ای با آدنوکارسینوم اندومتر تفاوت دارند.الگوهای طبقه بنی متعددی جهت سارکوم های رحم پیشنهاد شده است که هم بستگی به نوع سلول و هم منشاء تومور دارد. تومورهای خالص تنها از یک نوع سلول تشکیل شده اند،حال آنکه تومورهای مختلط حاوی چند سلول می باشند.تومورهای هومولوگ حاوی اجزای بافتی هستند که برای رحم بافت خودی به تعداد می فرایند، در حالیکه تومور هترولوگ توموری است که حاوی اجزای بافتی غریبه برای رحم است،مانند رابدومیوسارکوم و کندروسارکوم از آنجا که بیشتر سارکوم های رحم در یکی از 4 طبقه بندی زیر قرار می گیرند،GOG یک سیستم طبقه بندی شده را قبول نموده است:
* لیومیوسارکوم
* سارکوم استرومایی اندومتر
* سارکوم مختلط همولوگ مولرین(کارسینوسارکوم)
* سارکوم مختلط هترولوگ مولرین (سارکوم مختلط مزودرمال)
شیوع نسبی هر یک از زیرگروههای سارکوم رحم به طور قابل ملاحظه ای در مقالات مختلف فرق دارد و در مطالعات اخیر شایعترین آنان سارکوم مختلط مزودرمال بوده است. معیارهای طبقه بندی سارکوم های رحم براساس تقسیم بندی FIGO برای کانسر اندومتر است.
بیمارانی که مبتلا به سارکوم رحم می شوند اغلب در سنین بعد از یائسگی قرار دارند. در زنان دهه 40 و 50 لیومیوسارکوم شایعترین تومور است، حال آنکه سارکوم مختلط مزودرمال و سارکوم استرومایی اندومتر اغلب در زنانی که 10 سال بزرگتر هستند روی می دهند.شایعترین علائم یک خانم مبتلا به سارکوم درد و توده شکمی هستند.یک رحم که سریعاً رشد می کند و بزرگ می شود ممکن است علامت شایعی باشد ولی در صورت وجود چنین علامتی در زنان یائسه، نباید آن را به میوم رحمی نسبت داد،بلکه به
آن باید سارکوم را در نظر گرفت. همچنین،خونریزی غیر طبیعی رحم یک شکایت شایع است و در معاینه یک توده پولیپ شکل خونریزی دهنده ممکن است از سرویکس متسع خارج شده باشد. درصورت وجود چنین علائم و نشانه هایی، ارزیابی هیستولوژی رحم لازم است. اگر یک تومورازسرویکس خارج شده باشد، معمولاًبافت آن به آسانی در دسترس است، ولی اگرتشخیص لیومیوسارکوم باشد، معمولاً ضایعه در بالای رحم قرار داشته و فقط با کمک D&C قابل دسترسی است. تقریباً 50% از تمام بیماران مبتلا به سارکوم رحمی در مرحله I بیماری کلینیکی مراجعه می نمایند ولی حدود 1/3 این بیماران در زمان عمل جراحی ، بیماری پیشرفته تری دارند.
لیومیوسارکوم
مطالعات قدیمی پیشنهاد نماینده این است که لیومیوسارکوم شایعترین سارکوم رحمی است ولی اخیراًتعیین شده که کمتر از 25% از این تومورها را شامل می شود. همانطور که قبلاً دیدیم،این بدخیمی در زنان جوانتر که میانه سنی آنها درزمان تشخیص بین 43 تا 53 سال است، دیده می شود.لیومیوسارکوم درزنان سیاه پوست شایعتر بوده و با پیش آگهی ضعیف تری در این افراد همراه است الگوی انتشار لیومیوسارکوم از طریق شبکه لنفاتیک و عروقی است و متاستاز دوردست در بسکمک از بیماران حتی اگر لنف نودها در زمان عمل جراحی در گیر نباشند دیده می شود.هرچند درمورد معیارهای دقیق هیستولوژیک که برای تشخیص لیومیوسارکوم لازم است، هنوز اختلاف نظر وجود دارد، به نظر می رسد مهمترین فاکتور، تعدادش میتوتیک تومور باشد. میوم های سلولی و لومیوم های بد شکل ممکن است بدخیم به نظر برسند،ولی اگر کمتر از 5 میتوز در 10 نمای با قدرت بزرگنمایی بالا وجود داشته باشد (HPFS)،ضایعه خوش خیم تلقی می شود.تومورهایی که بیش از 10میتوز در 10 نمای با قدرت بزرگنمایی زیاد دارند بدخیم هستند و اگر تعداد میتوزها بین 5 تا 10 عدد باشد پتانسیل بدخیمی تومور ناتعیین است. بسکمک از محققین معتقدند که میزان بقای 5 ساله به تعداد میتوزها در هر 10 نمای با قدرت بزرگنمایی زیاد بستیگی دارد،اگرتعداد میتوز کمتر از 5 عدد در هر 10HPF باشد میزان بقا 98-95% است، اگر بین 10-5 باشد، تقریباً 40% و اگر بیش از 10 باشد، امید به زندگی بسیار ضعیف و در حد 20-15% خواهد بود.
تومور استرومای اندومتر
این تومورها معمولاً به 2 گروه تقسیم می شوند: میتوز اندولنفاتیک استروما و سارکوم اندومتریال استروما.نوع اولمعمولاً یک سیر بطئی داشته و یک سارکوم استروما با درجه بدخیمی پایین تلقی می شود. در نمای ظاهری،معمولاً یک الگوی رشد منتشر شونده دارد و می تواند از سطح برش داده شده با یک الگوی کرمی شکل برجسته شود و همچنین در عروق خونی لیگامان پهن انتشار یابد.درنمای میکروسکوپی،آتیپی مختصر سلولی و میتوزهای اندک وجود دارد سیر بالینی بسیار آهسته بوده و درمان فقط از طریق جراحی است.
سارکوم استرومای اندومتر،برخلاف نوع قبلی، یک سیر بسیار تهاجمی تر داشته و متاستاز در آن شایع و پیش آگهی آن بسیار ضعیف است. همانند لیومیوسارکوم، افتراق بین این دو نوع تومور بستگی به تعداد میتوزها در هر10 نمای میکروسکوپی با قدرت بالا دارد، وتعداد 10 میتوز، معیار قابل قبولی برای تقسیم بندی تومور به نام سارکوم استرومای اندومتر است. این تومورها حاوی تراکم بالایی از هر دو نوع گیرنده استروژنی و پروژسترونی هستند و ندرتاً ممکن است با تجویز پروژسترون با میزان زیاد، پاسخ درمانی در آنها دیده شود.
تومورهای مختلط مولرین
این تومورهای شایعترتین سارکوم های رحم هستند و بیش از 50% تمام موارد سارکوم را در مطالعات اخیر شامل می شوند.از لحاظ بافت شناسی، از 2 جزء سارکوم و کارسینوم تشکیل شده که اجرای سارکوماتوز به 2 نوع همولوگ (بافت طبیعی که در رحم یافت می شود) و هترولوگ (بافت هایی مانند غضروف و استخوان) تقسیم می شوند. این بدخیمی در سیاه پوستان شایعتر بوده و در 1/3 موارد سابقه رادیاسیون لگن در بیماران وجود دارد. علامت اصلی بیمار، خونریزی رحمی است و در معاینه، بیشتر بیماران، یک رحم بزرگ و اغلب همراه با یک توده پولیپ شکل دارند که از سرویکس خارجی شده است.این تومور سیر تهاجمی داشته و متاستاز زودرس به لنف نودهای لگن و اطراف آئورت و بافت های مجاور دارد. انتشار خونی،به خصوص به کبد و ریه های شایع است.درمان سارکوم های رحم
اولین قدم در درمان سارکوم های رحم در مراحل اولیه جراحی است، که شامل یک لاپاراتومی تجسسی، هیسترکتومی کامل شکمی و سالپنگواووفورکتومی دو طرفه است. به دلیل تمایل تومور به متاستاز لگنی و لنف نودهای اطراف آئورت، برخی از مولفین نمونه برداری انتخابی از این نواحی را پیشنهاد می نمایند. حتی در مراحل اولیه بالینی این بیماری،تقریباً نیمی از بیماران، توسعه بیماری را به خارج رحم دارند و دراین موارد،پیش آگهی بسیار ضعیف است. بر اساس یافته های جراحی و پاتولوژی،می توان درمان کمکی با رادیاسیون لگن یا شیمی درمانی را پیشنهاد کرد. ندرتاً ممکن است برداشتن یک متاستاز منفرد ریوی از طریق جراحی شفابخش باشد. بیماران مبتلا به بیماری راجعه بسیار پیش آگهی بدی داشته و باید در یک آزمون بالینی عوامل فعال شیمی درمانی مناسب جهت آنان تعیین شودمنبع:مامایی و بیماریهای زنان دنفورث،جلد دوم.
/ج
منبع: راسخون